巡る検討会、GMP導入を議論 有識者の意見一致、サプリメントは義務化へ
機能性表示食品のサプリメントを消費者庁へ届け出る際の製造・品質管理の要件に、医薬品を参考にしたGMP(適正製造規範)が加わりそうだ。
機能性表示食品の使用で消費者に健康被害が生じたことを受け、制度の見直しに向けた議論を先月中旬から進めている消費者庁の有識者検討会「機能性表示食品を巡る検討会」は10日午後、全6回中4回目の会合をオンラインで開き、健康食品GMP第三者認証機関や医薬品GMP専門家などからの意見聴取を交え、機能性表示食品の生産・工程管理のあり方を議論。機能性表示食品は生鮮食品を含む食品全般を対象にしているが、サプリメントに限定したGMP義務化の方向性で意見の一致をみた。事業者の準備期間を設けることでも意見が一致した。
サプリメントの「定義」は?
欧米など海外諸国と異なり日本は、サプリメントを定義付ける法律がない。ただ、行政通知レベルでは一定の定義が示されている。厚生労働省が今年3月に発出した通称、令和6年通知(旧平成14年通知)の一部で、現在、同通知を所管する消費者庁が「GMP通知」と呼ぶ、「錠剤、カプセル剤等食品の製造管理及び品質管理(GMP)に関する指針(ガイドライン)」では、通知の対象食品を次のように記述する。
「天然物、若しくは天然由来の抽出物を用いて分画、精製、濃縮、乾燥、化学的反応等により本来天然に存在するものと成分割合が異なっているもの又は化学的合成品(中略)を原材料とする錠剤、カプセル剤等食品」
同じく通知である機能性表示食品の届出ガイドラインでも、サプリメント形状の加工食品(サプリメント)をおおむね同様に説明。錠剤、カプセル剤の他に「粉末剤、 液剤等」も対象とする。その上で、サプリメントについては、GMPに基づく製造工程管理を「強く推奨」している。それを今後、法令(府令や告示)に基づく「義務」とする方向性に反対する有識者の意見は、この日の検討会では出なかった。
実行可能性を考慮する必要、「形ばかりのGMPではダメ」
食品衛生法は、HACCPに沿った衛生管理の実施を原則、全ての食品事業者に求める。今後の機能性表示食品制度の見直しでは、サプリメントの製造工程管理の要件に従来からのHACCPに加え、「GMP通知」の内容を踏まえたGMPを取り入れることになる見通し。HACCPとGMPを車輪の両輪とし、製品の安全性や品質などを担保していく方向性になりそうだ。
検討会の構成員の一人で、元厚生省医系技官の三浦公嗣・藤田医科大学特命教授は、「形ばかりのGMPということではなく、(事業者の)実行が上がるためにはどうするかを考えていく必要がある」と指摘。その上で、小規模事業者も含めて自主的にGMPでの管理を実施できるようにするための「技術的支援をどうしていくかを考える必要がある」と述べ、事業者の実行可能性を考慮に入れるよう意見した。
機能性表示食品に限らず、サプリメント全般の品質確保にGMPを推奨している「GMP通知」は、「サプリメントGMP」を実施した製造工程管理の全体像を提示している。この日の検討会でも消費者庁の担当課がその説明に当たり、医薬品や海外のサプリメントGMPと同様に、①原材料の受け入れ、②製造管理、③品質管理、④出荷可否の判断といった一連の製造・品質管理の流れの遵守が重要だと説明した。製造管理と品質管理の各部門がそれぞれ独立して相互にチェックする管理体制を構築したり、製造標準書等の書類や製造記録などを作成したり、保管したりする必要もある。
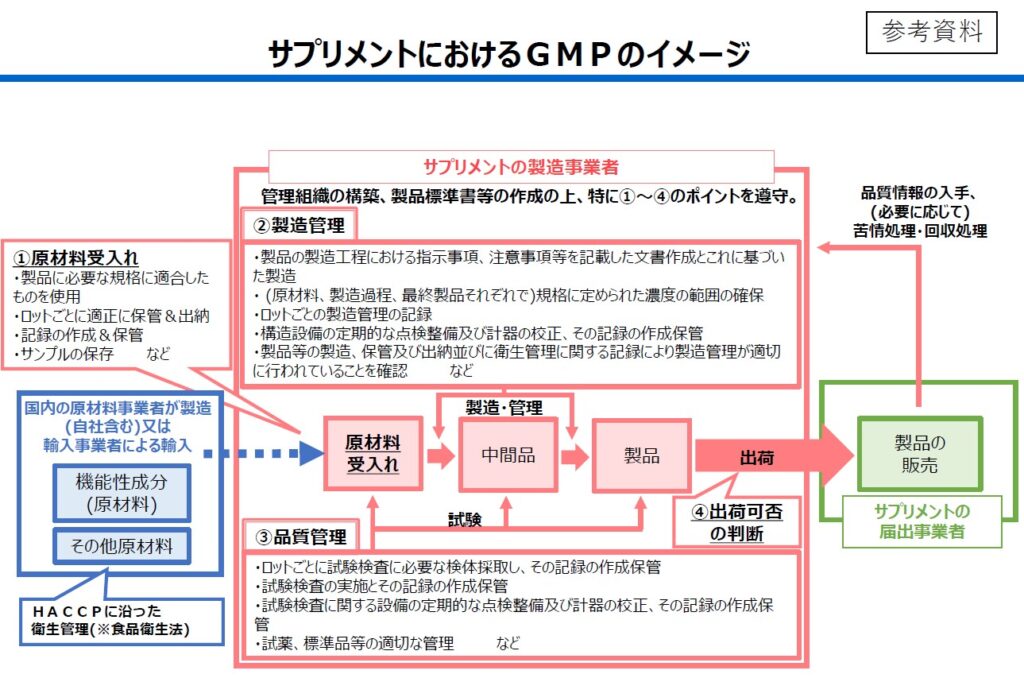
原材料の品質管理、「受け入れ検査」で対応?
一方、この日の検討会では、最終製品の製造・品質管理についてGMP義務を導入する方向性で意見が一致したものの、GMP導入をめぐる論点には、海外から輸入している場合も多い、機能性関与成分を含む原材料、その他の原材料の製造・品質管理についても、GMPを義務付けるかどうかもある。この点は、今後の検討になる見通しだが、この日の検討会の議論からは、原材料の品質管理は、最終製品を製造する際の第1ステップとなる「原材料の受け入れ」の部分で対応していく方向性が色濃く浮かび上がっている。
「GMP通知」は、原材料について、「本ガイドラインに従った製造管理を行うことが望ましい」とし、「望ましい」という弱い表現での要求にとどまる。その上で、原材料の製造・品質管理については、製品標準書の規格に適合したものを使用すること、ロットごとに適正に保管、出納を行うこと──などを最終製品製造事業者に対して求めている。
合田構成員、原材料の「パターン分析」に言及
その中で、この日の検討会では、構成員の合田幸広・国立医薬品食品衛生研究所名誉所長が「原材料の受け入れが(最終製品の安全性や品質を確保するための)クリティカルポイント。原材料の受け入れ試験を正確にやることが非常に重要だ」と指摘した。
合田構成員はまた、機能性表示食品に配合される機能性関与成分を含む原材料は直接的にせよ、間接的にせよ、「ヒト試験が行われている」とした上で、ヒト試験で安全性が確認された原材料と同じものであることを確認するためのパターン分析(機能性関与成分などの含有成分をHPLCなどの分析機器で鑑別すること)が製造・品質管理の過程でしっかり運用されていれば、「今回の問題(小林製薬の機能性表示食品に生じた健康被害問題)は起きなかったと思う」とコメント。最終製品製造時の原材料受け入れで「同質性をしっかり確認する。そうした分析をしなければならないということを明確にし、それを(実際に)やっていることが非常に重要だ」と指摘した。
原材料の受け入れも含めてGMPでの製造・品質管理が届出者(事業者)に義務付けられた場合、「(最終製品を製造する)製剤メーカーがパターン分析にまで十分対応できるかどうかが(実行可能性の)課題になる。ただ、製品に使用する全ての原材料を分析するのは困難。パターン分析結果と共に原材料を供給できる(原材料)事業者に対するニーズが高まっていくのではないか」と、会合を傍聴した業界関係者は見る。
求められる、製造に携わる全ての人の「慎重な配慮」
この日の検討会は、HACCPに沿った食品衛生管理を食品関連事業者に指導、普及啓発する(公社)日本食品衛生協会、健康食品GMP第三社認証機関の(公財)日本健康・栄養食品協会と(一社)日本食品規格協会、医薬品GMPに詳しい櫻井信豪・東京理科大学薬学部教授の1者3関係団体から意見聴取を行った。
櫻井氏は、GMPの基本要件として、間違い防止・汚染防止・品質保証システムの3つを挙げ、原材料の受け入れから最終製品の出荷までの全行程で、不良製品の流通防止に必要な要件をまとめたものがGMPだとした。また、製品の安全性や品質を保つためには、製造、品質検査だけでは十分ではないと指摘。「製造に携わる全ての者の『慎重な配慮』」が必要不可欠だと強調した。

次回、5回目の会合は、今月17日午前10時からオンラインで開催する。検討テーマは「消費者等への情報伝達のあり方」。引き続き関係団体等からの意見聴取を行う。その後、最終回となる6回目の会合を5月末までに開き、機能性表示食品制度の今後のあり方の方向性を提示する。
【石川 太郎】
(冒頭のイラスト:「巡る検討会」を構成する有識者全9人の似顔絵/文中の画像:上=消費者庁が示した令和6年通知に基づくサプリメントGMPの全体像イメージ、下=櫻井信豪・東京理科大学薬学部教授が示したスライド。いずれも第4回会合配布及び参考人提出資料から)
検討会関連記事:検討会設置の背景は?
:【第1回】度な規制強化、「いわゆる健康食品」に流れる恐れ
:【第2回】安全性に照準 制度見直し後のルール、「法令化が必要」
:【第2回関連】業界団体、風評被害の大きさ訴える
:【第3回】健康被害疑い情報、報告義務化へ 医師の診断伴う情報主体に
その他の関連記事:通知改正のポイントを聞 新開発食品保健対策室専門官との一問一答
:新通知、GMP認証機関はどう見るか① (公財)日本健康・栄養食品協会の増山明弘・健康食品部長に聞く
:新通知、GMP認証機関はどう見るか② (一社)日本健康食品規格協会の池田秀子理事長に聞く






















