サプリの安全性と「3.11通知」 制度改正で増した重要性、民間機関は原材料を重視する
小林製薬「紅麹サプリ」をめぐる健康被害問題が明らかになる直前の今年3月11日に厚生労働省が発出、現在は消費者庁が所管する健康食品の安全性確保を目的にした通称「3.11通知」。事業者の自主的な取り組みによって、原材料から最終製品まで、錠剤やカプセルなど通常の食品とは異なるリスクを持つサプリメントの安全性を確保するための指針(ガイドライン)だ。
機能性表示食品制度改正に絡み法令化
健康被害問題が起きて以降、健康食品業界にとって、3.11通知の重要性は大きく増している。通知を構成する2つの指針のうち、「錠剤、カプセル剤等食品の製造管理及び品質管理(GMP)に関する指針」(別添2)の内容が、9月1日に一部実施された機能性表示食品制度の大改正に伴い、法的拘束力を持つ法令に落とし込まれたからだ。
法令の名称は、「機能性表示食品のうち天然抽出物等を原材料とする錠剤、カプセル剤等食品の製造又は加工の基準」(内閣府告示第108号)。
制度改正で、機能性表示食品のうち「天然抽出物等を原材料とする錠剤、カプセル剤等食品」(以下、サプリメント)の製造工程・品質管理に、医薬品を参考にしたGMPが義務付けられた(9月1日施行、2026年8月31日まで経過措置)。食品表示法に基づく食品表示基準(内閣府令)を根拠法令とする同告示は、サプリメントの機能性表示食品の届出者や最終製品製造事業者などが販売開始後も含めて遵守すべき、法的拘束力を持つ製造工程・品質管理の要件として運用される。
届出者の「責務」を規定した第4条
告示の中身について、サプリメントの機能性表示食品を届け出る事業者がとりわけ注目すべきは、第4条「届出者の責務」だ。届出者に対し、次のことを「しなければならない」と要求している。
1. 届出に係わる天然抽出物等を原材料とする錠剤、カプセル剤等食品を製造等する者がこの告示に従って製造等を行うことを確保しなければならない。
2. 天然抽出物等を原材料とする錠剤、カプセル剤等食品の製造等に使用する原材料(機能性関与成分を含む原材料に限る。)について、製造者等が作成する製品標準書に記載した規格に適合したものが供給されることを確保しなければならない。
「規格に適合したもの」とは、「安全性が確認された一定品質の原材料と同等であること」と同義だろう。その意味では、第8条「製品等の製造管理」の第2号にも注目したい。直接的には製造者等に、間接的には届出者に対して、次のように求めている。
「機能性関与成分については、同等(基原材料および純度が一致している場合をいう。)性及び均一性が確認された原材料を用いて、製品標準書等に記載した規格に基づき管理を行うとともに、製品においても均一化し、当該規格に定められた範囲を確保すること。」
告示に落とし込まれる安全性自主点検
今回の制度改正でGMP義務のかかる範囲は、最終製品の製造工程(原材料の受け入れから出荷まで)に留め置かれた。原材料については、機能性関与成分を含む原材料の製造工程に関してはGMP管理が「望ましい」とされているが、原則的には、食品衛生法に基づき、HACCPに従った衛生管理を基本とする安全性の確保を求められるに過ぎない。
ただ、前述のとおり告示には、最終製品のみならず、原材料の安全性確保に関わる要求事項がしっかり盛り込まれている。それだけではない。3.11通知を構成するもう1つの指針、「錠剤、カプセル剤等食品の原材料の安全性に関する自主点検及び製品設計に関する指針」(別添1)の内容も、機能性表示食品制度の改正に絡み、本年度末までに公布される新たな内閣府告示に落とし込まれることになる。
3.11通知の別添1には「別紙」が付けられている。そこに示されているのは、錠剤、カプセル剤等食品の「原材料の安全性」を事業者が「自主的に点検」するためのフローチャート。それも含めて告示に落とし込まれる予定だ。つまり、そのフローチャートの内容に従い、原材料の安全性が点検されていることが、法令に基づく、機能性表示食品の要件になると考えられる。
容易ではない安全性点検フローチャート
フローチャートに示されたステップを順に追って見ていくと、まず、ステップ「1」では、製品の製造に用いる原材料が何であるかを明確にし、各原材料を「点検対象原材料」(健康の維持・増進を意図して配合される天然抽出物等である原材料)とそれ以外に分ける。次にステップ「2」で、点検対象原材料の基原材料(原材料を製造するために使用する動植物、またはその特定部位、化学物質、微生物など)の食薬区分の他、点検対象原材料が適正な製造工程管理の下で一定の品質を常に保つかたちで製造されているかなどを確認する。
そしてステップ「3」で、喫食実績(食経験)を確かめる。ここで問われるのは、「社会通念上、十分な食経験がある通常形態(錠剤、カプセル剤、粉末剤、液剤等の形状である加工食品を除く)の食品で使用されており、かつ、通常形態の食品と比べて同等以下の摂取量となるか?」だ。

欧米などとは異なり、日本には、食経験が「ある」と言える年数の具体的な規定がない(米国は25年、欧州は原則30年、豪州は1~2世代などと規定)。そのうえ、それなりに長い食経験のある基原材料を使用していて、通常形態の食品と比べて同等以下の摂取量であったとしても、製法等が一般的ではない場合は、同等性の観点から、食経験が「ある」と言い切れるかどうか微妙だ。
求められる網羅的な文献検索
その中でも十分な食経験が「ある」と評価できるのであれば、最終ステップの「7」まで進むことができる。一方で、そうは評価できない場合、ステップ「4」と「5」で網羅的な文献検索を行う必要がある。
ステップ「4」では、点検対象原材料とその基原材料の安全性及び毒性に関する文献調査、そして「5」では、点検対象原材料とその基原材料に含まれる「成分」の安全性、毒性、医薬品との相互作用などに関する文献調査をそれぞれ行うことになる。
文献調査の結果、「有害性が知られる成分(アルカロイド、トキシン、ホルモン、発がん物質、神経毒性物質、催奇形性物質(編集部注:先天異常を引き起こす可能性のある物質のこと)、遺伝毒性物質、その他の毒性物質)またはその構造類縁物質が含まれる」という情報が「ない」場合、原則的にはステップ「6」の安全性試験の実施に進む(安全性試験を行わずに安全性を確保できる合理的な理由がある場合は省略できる)。
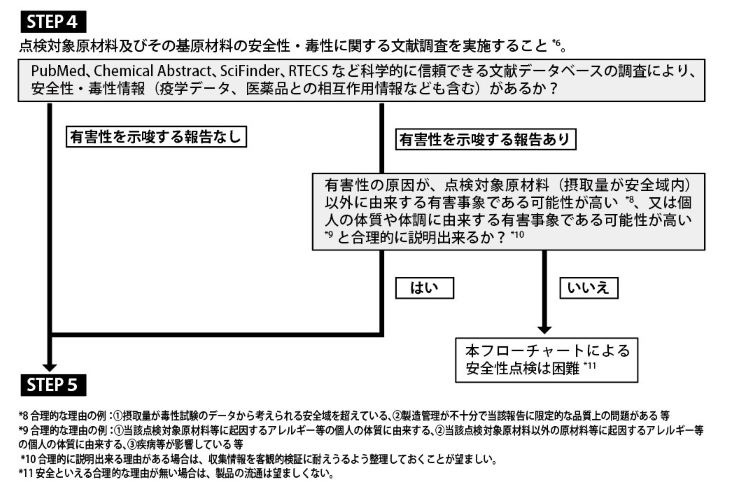
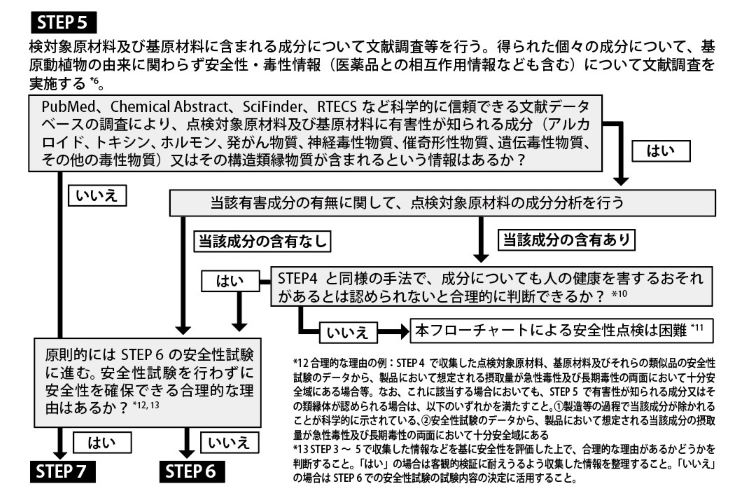
そしてステップ6で「人の健康を害するおそれがあるとは認められない」と評価できれば、最終ステップである「7」に進み、「本フローチャートに従って、原材料について一定のレベルの安全性点検がなされている」と判断できる、というのが自主点検フローチャートの流れだ。ステップ「4」と「5」で求められる網羅的な文献検索を適正に行えているかどうかが安全性自主点検の胆になる。

GMP、原材料の安全性が担保されてこそ
3.11通知の原型は、健康食品の安全性確保の実効性を確保するため、厚労省が2005年に発出した通称「平成17年通知」である。健康食品の利用の広がりをはじめ、GMP管理や健康被害情報の報告を義務づけるなどとした、食品衛生法に基づく指定成分等含有食品制度の施行といった健康食品を取り巻く環境、状況の変化を踏まえ、「最新型」に改められた。
3.11通知は、小林製薬「紅麹サプリ」をめぐる健康被害問題の発生を受け、たまさか機能性表示食品を対象に法令化されることになったが、機能性表示食品を製造・販売していなければ関係ない、ということは決してない。国は、健康食品関連事業者全般に対し、同通知を踏まえた安全性の確保を推奨している。
「まずは原材料の安全性を確認する。次に、(原材料の安全性確認結果を踏まえて最終製品の)製品設計を適切に行う。製品設計は平成17年通知では求められていなかった要素です。GMPでの製造と品質管理は、それらを適切に実施した上で初めて意味を持つのだという、国際的にサプリメントに求められている安全性と品質を確保するための順序立てを、明確に強く打ち出した通知になっています」
「新たな通知(3.11通知)のポイントは、基原材料から最終製品までの安全性確認と品質管理を一本化したこと。さらに、製品設計という重要な要素を新たに加えたこと。そして、原材料から最終製品まで、製造・販売する事業者の全てが対象であることを明確に示したことです」
サプリメントGMP第三者認証機関、(一社)日本健康食品規格協会(JIHFS)の池田秀子理事長は、サプリメントの安全性や品質の確保に対する3.11通知の意義をそう語る。
改正・機能性表示食品制度の設計を主導した消費者庁は、そうした意義を持つ通知の内容を、機能性表示食品に関する法令(告示)に落とし込むことにした。安全性と品質を確保するためには、原材料にもしっかり目を向ける必要がある。そうしたメッセージと受け止めるべきだろう。
3.11通知に基づく新認証をスタートさせるJIHFS
JIHFSは現在、3.11通知に基づく、原材料の安全性自主点検認証を新たに始めるための準備を進めている。この認証では、事業者の自主点検結果が、現時点の科学的知見を踏まえ、妥当かどうかを評価委員会が第三者として審査、判定する。認証の意義を高めるために、自主点検で最も重要な文献検索をサポートする活動を始めることも検討している。
評価委員会には、袴塚高志・日本薬科大学薬学部教授を筆頭に、元国立健康・栄養研究所情報センター長の梅垣敬三氏、元日本漢方生薬製剤協会国際委員会長の諸田隆氏(元ツムラCMC開発研究所長)の3識者が就任した。JIHFSは今、以前から運用している原材料製造施設に対するGMP認証の他、今夏新たにスタートした輸入原材料GMP認証とともに、最終製品の起点となる原材料の安全性と品質の確保を、第三者の立場で支援しようとしている。
【石川太郎】
(冒頭の写真:3.11通知の「別添1」/文中の図:3.11通知別添1別紙を基に編集部で作成)
関連記事:3.11通知等のポイントは? 新開発食品保健対策室専門官との一問一答
:新通知(3.11通知)、GMP認証機関はどう見るか JIHFS・池田秀子理事長に聞く
:JIHFSの輸入原材料GMP認証、審査体制固まる






















