CBD薬治験、日本で失敗 厚労省も失敗認める、今後の見通しは不明
ジャズファーマシューティカルズジャパン㈱(旧GW Pharma、東京都千代田区)が2024年8月、日本で実施していたてんかん治療薬『Epidyolex(エピディオレックス)』の治験で失敗したという海外誌の報道について、ウェルネスデイリーニュースは4月17日付のニュースで紹介した。その後、編集部が同社に直接確認したところ、事実であることが裏付けられた。
「日本での治験、主要評価を満たせず」(ジャズファーマ)
日本では21年1月20日~6月11日までの半年間、「大麻等の薬物対策のあり方検討会」を8回にわたり開催し、同6月25日に報告書を公表した。
報告書では、基本的な見直しの方向性として、大麻使用罪の導入や従来の「部位規制(大麻草の茎や種子は対象外)」から、「成分規制」への見直しの提言などの他、G7諸国では医療用大麻として解禁済みの「難治性てんかん治療薬」などについて、日本でも製造・施用を可能とすべきとした。
そして23年12月、厚労省は大麻取締法を改正し、「大麻草の栽培の規制に関する法律」と名称変更して公布。昨年12月から、カンナビジオール(CBD)などの大麻草由来成分を含む医薬品の施用が一定の条件下で可能となった
ところが、冒頭に示したとおり、ジャズファーマシューティカルズは昨年8月、日本人患者を対象としたエピディオレックスの第Ⅲ相治験、非盲検、単群臨床試験のトップライン結果を発表。「臨床試験では、日本人小児患者において、治療期間(最大16週間)における対象疾患に関連する発作頻度のベースラインからの事前に定められた変化率という主要評価項目が達成されなかった」(同社)としている。
同社は、「引き続きエビデンスの創出に取組み、日本において高い医療ニーズが満たされていない患者に1日も早く弊社の医薬品を届けるべく尽力していく」としているものの、現状についてはつまびらかにしていない。
期待高まる中での失敗に厚労省の対応は?
この臨床試験の失敗により、大麻由来成分を用いた医薬品の市場への導入に遅れが生じることは否めない。
厚生労働省には、麻薬や医薬品の規制に関わる医薬局監視指導・麻薬対策課の他に、医薬品の承認審査を行う「医薬局医薬品審査管理課」、研究開発を所掌する「医政局研究開発政策課」がある。何らかのかたちで臨床試験に関わっているとみられるのは、後者2つの課。編集部が取材を試みたところ、医薬品審査管理課から話を聞くことができた。
大麻草由来のてんかん治療薬として注目された「エピディオレックス」について、開発元のジャズファーマシューティカルズが日本国内で実施した第Ⅲ相治験の評価項目を達成できなかったことが明らかになった件に関し、厚生労働省は、きのう(21日)の取材対応で「個別の医薬品開発や申請の有無については、企業の営業秘密にあたる」として言及を避けた。
再開発の有無、依然として未定
厚労省は、「承認されていないという事実以外にはお答えできない」とした上で、「仮に承認申請が行われた場合には、通常どおり適切に審査を進める」との姿勢を示した。さらに、今後の承認の見通しや、同製品に限らず他の大麻由来医薬品の開発状況についても、「申請があれば審査するという一般論以上は話せない。どの部署に問い合わせても、個別案件については同様の対応になる」と強調した。
同薬の承認に向けた国内法の整備はすでに進んでおり、2023年には大麻取締法が改正され、大麻草由来成分を含む医薬品の製造・販売が法的に可能となった。だが、厚労省は「法改正はあくまで大麻草由来成分を医薬品として扱えるようにしたにすぎず、個別製品の開発や承認を促進するものではない」と釘を刺す。
なお、厚労省の公式サイトでは「エピディオレックス」が国内治験中と明記されていたが、今回の治験失敗によって、今後の再申請や別手法での開発継続がなされるかは不透明なままである。
厚労省との一問一答はこちら(⇒つづきは会員記事閲覧専用ページへ)
<一問一答>
記者 ジャズファーマの臨床試験の失敗を受けてお訪ねします。厚労省において、今の状況と今後の対応というのは何かございますか。
厚労省 企業の情報なので承認していないという事実以上は答えられない。申請の有無も含めてお答えできないが、当然ながら審査中というステータスになればそれは適切に審査は進めていくということに尽きる。正直申し上げて、これ以上は企業の営業の利益に関する情報ということでお答えできない。
記者 今後についても?
厚労省 今後の話も、基本的には審査というところにステータスが移れば、そこは適切に対応するというぐらいか。
記者 ジャズファーマの方では、これからも尽力するとの回答があったが――。
厚労省 多分申請していないのだと思うが――。そもそも(申請)されてないものに関してはまだ何とも言えなくて、(申請)されたらちゃんと審査するということになる。今後の話も、そういう意味ではちょっとお答えできない。
記者 ただ一般論としてというか、一応、厚生労働省のホームページでは、すでにこのエピディオレックスについて国内で治験が開始されているが云々とある・・・
厚労省 それは承知している。
記者 固有名詞を挙げている。それがダメになって、一応失敗したということだが。
厚労省 はい。
記者 そしたらこの後、これ以外でも結構だが、厚労省の方で今後、医薬品として承認していくに当たり、何らか別の手立てとか、そういったものというのは?
厚労省 それについては、厚労省が承認するために何か頑張るという話ではないというふうに考える。企業が開発しているものを踏まえて、それは適切に審査していくという話で、個別の製品を応援するために何とかするとかいう話ではない。
記者 ただ新しいてんかん治療薬をやっていくために法改正されたのでは?
厚労省 それは大麻由来のものが医薬品として取り扱えないので、医薬品として取り扱えるように改正をしていくという話だというふうに認識をしている。
それを踏まえて、大麻草由来の医薬品の開発が行われているのだが、ジャズファーマに聞いたとおり、国内の第三相試験が評価項目を達成しなかったという状況だというのが現状で、それ以外に何かあるのかという話は承知してないというか、承知していたところでも答えられないというところ。
記者 承知していても答えられない?
厚労省 各社の開発状況というのは、各社の情報になるので、厚労省からお答えすることはできない。
記者 各社というか、その名前を挙げなくても、、、、
厚労省 もしあるとして、それが開発されているとしても、その企業がやっている情報なので、こちらで何か答えるという話ではないと思っている。
記者 現状、私の問いに対しては、やっているかやっていないかも含めて答えられないということか。
厚労省 そうだ。こちらの開発に関する情報はお答えしかねるというところにある。
記者 医政局研究開発政策課に聞いても、これ以上の話は出てこないということか?
厚労省 どこに聞いても、個別の医薬品の開発状況は答えられないということになると思う。
記者 ただし国の利益として、この医薬品の開発が、少なくとも今遅れているということは間違いない事実という認識か。
厚労省 一般論として、まだ承認してないというのは事実としてあり、それは答えることができる状況にある。
【解 説】
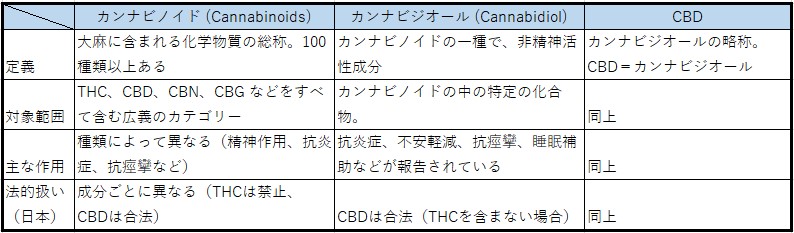
カンナビノイドとは何か?
カンナビノイド(cannabinoid)、カンナビジオール(cannabidiol)、CBD は、いずれも大麻(Cannabis sativa)に含まれる化学成分。カンナビノイドは総称で、カンナビジオール(=CBD)
はその中の1成分とされる。それぞれ大麻植物に由来する化学物質だが、範囲や用途に違いがある(下表参照)。
欧米で広がるCBD医薬品の実態
近年、医療用大麻の成分であるカンナビノイドを用いた医薬品の承認・使用が欧米諸国で拡大している。特に難治性てんかんに対するCBD(カンナビジオール)製剤『エピディオレックス』は、その代表例として国際的に注目を集めている。
同製剤は2018年に米国食品医薬品局(FDA)から、2019年には欧州医薬品庁(EMA)からそれぞれ承認を受けており、カナダやオーストラリアでも医療用としての使用実績がある。日本国内では未承認だが、海外においては医師の処方の下、制度的に位置付けられた管理下で流通している。
使用対象となる疾患は、ドラベ症候群やレノックス・ガストー症候群といった小児期発症の難治性てんかんとされている。これらはいずれも従来の抗てんかん薬では十分な効果が得られにくい重篤な症状を伴うもの。
さらに、国や地域によっては適応範囲が広がりを見せており、抗がん剤治療に伴う悪心・嘔吐の抑制、多発性硬化症(MS)やがんに伴う神経因性疼痛、HIV/AIDSによる食欲不振など、QOL(生活の質)の向上を目的とした利用も進んでいるようだ。
こうしたカンナビノイド医薬品は、各国において安全性・有効性・品質に関する厳格な審査を経て承認されており、一般的な大麻草や嗜好用大麻とは明確に区別されている。多くの国では、スケジュール管理された規制薬物として扱われ、医師による処方に限定されるかたちでの流通が確保されている。
一方、日本においては、大麻取締法が部位規制に基づく構造となっているため、大麻草の花穂や葉を原料とするCBD製剤であっても、原則として製造・輸入・施用が禁止されてきた。これが日本国内での医薬品開発・承認の大きな障壁となっていた。
【田代 宏】






















