求められる包括的な法整備(後) 【寄稿】健康食品制度の重大な欠陥と改善案
東京大学名誉教授 唐木英明
健康志向の高まりを背景に、日本の健康食品市場はいまや1兆円を超える規模に拡大している。しかしその一方で、制度面の整備は追いつかず、複雑で矛盾を抱えたまま。唐木英明東京大学名誉教授は、現行制度の根本的欠陥を明らかにし、新たな「健康食品法(仮称)」の創設を提案する。その課題と解決への道筋を前後編で探る。
4 評価手法の誤謬:「無効論」を生み出す評価基準
「健康食品は効かない。もし効果があるなら医薬品になっているはずだ」という主張は、不要論を支える大きな論拠となっている。しかし、この「無効論」は、健康食品の有効性を正しく評価できないように設計された、欠陥のある試験が作り出した物語である。
「健康な被験者」という制約
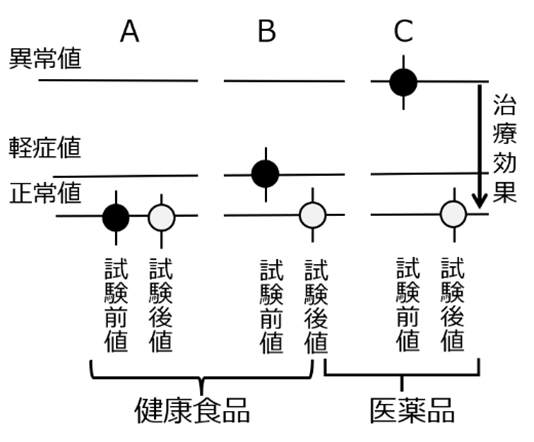
機能性表示食品の届出ガイドラインは、試験の対象者を「疾病に罹患していない者(未成年者、妊産婦、授乳婦を除く)」と規定している。これは、健康食品を医薬品と明確に区別するという政策的意図に基づくものだが、科学的評価の観点からは深刻な問題を含んでいる。健康食品が期待される主な効果は、「健康維持(疾病の予防)」と「軽症の改善」の二つだが、いずれの効果も「健康な被験者」では適切に測定することができない。
疾病予防効果の評価困難性:健康食品による疾病の一次予防効果(例えば、将来の骨粗鬆症リスクを低減させるなど)を科学的に証明するには、ワクチンの有効性評価で行われるような、数千から数万人規模の被験者を長期間追跡する大規模な疫学調査が必要となる。このような多額の費用と長い期間が必要な研究を食品企業に求めることは非現実的である。したがって、免疫機能の活性化を謳う一部の機能性表示食品で認められているように、基礎研究である試験管内試験や動物試験の結果から、ヒトでの効果を類推することをより広く認めるべきである。
軽症改善効果の評価困難性:軽症状態の改善(例えば、高めの血圧や血糖値を下げるなど)を目的とする製品を、正常な値を持つ健康な成人で試験しても、意味のある結果は得られない。なぜなら、彼らのバイオマーカーには改善の余地がほとんどなく、統計的に有意な変化を検出することが困難だからである。この問題に対応するため、ガイドラインでは「境界域」の被験者を対象とすることが認められている。しかし、境界域の被験者であっても、そのバイオマーカーは正常値に近いため、明確な治療効果を示すことが難しい場合が多い。ここでも、in vitro試験や動物試験の結果からの類推を認めるなど、より柔軟な評価手法の導入が求められる。
プラセボ対照試験の機械的適用
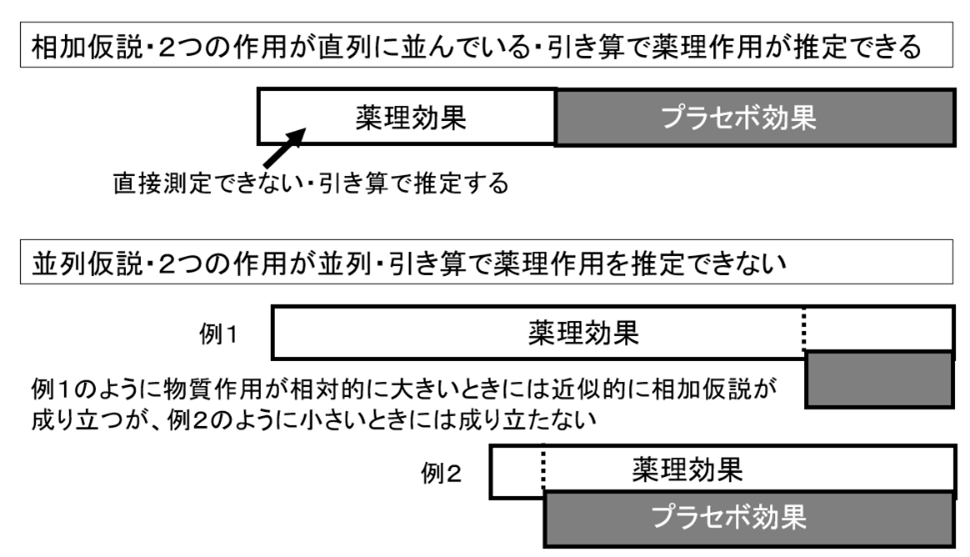
第二の、そしてより深刻な問題は、有効性評価のゴールドスタンダードとされるプラセボ対照試験(RCT)の義務付けである。この試験方法が健康食品の評価に不適切な理由は、その根底にある薬理学的仮定にある。RCTの解析では、試験食品を摂取した群での効果(全体効果)は、「薬理効果」と「プラセボ効果」の単純な足し算によって構成されると仮定される。すなわち、「全体効果=薬理効果+プラセボ効果」というモデルである。そして、被験食品の真の有効性は、全体効果からプラセボ効果を引き算することによって算出される(薬理効果=全体効果-プラセボ効果)。
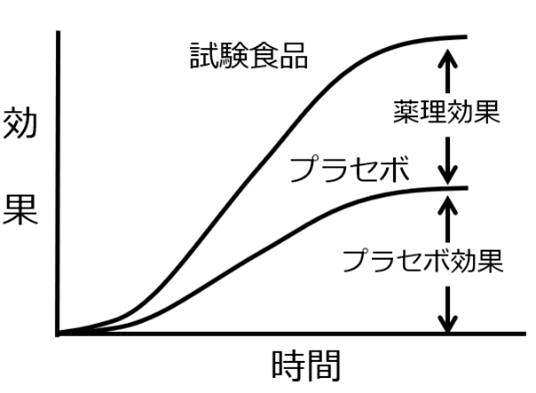
しかし、この「相加モデル」は、軽症者においては成り立たないことがある。医薬品の臨床試験において、軽症者ではプラセボ効果の大きさが医薬品自体の効果とほぼ同等になる例が多数報告されている。例えば、ひざの痛みを持つ被験者に、鎮痛剤セレコキシブとプラセボを投与すると、両者ともに有効であり、その差はない。ということは、鎮痛剤に陳津作用がないという判定になる。
これは、薬理効果とプラセボ効果が「相加」ではなく、互いに影響し合う、あるいは同じ生理的経路を共有する「並列」である可能性を示唆している。
健康食品の利用者のほとんどは、軽微な不調を抱える人々である。したがって、彼らを対象とした試験では、比較的大きなプラセボ効果が観察されやすい。その結果、相加モデルを適用すると、全体効果から大きなプラセボ効果が差し引かれ、算出される「薬理効果」はゼロに近い値となり、「無効」という結論が導き出されてしまうのである。
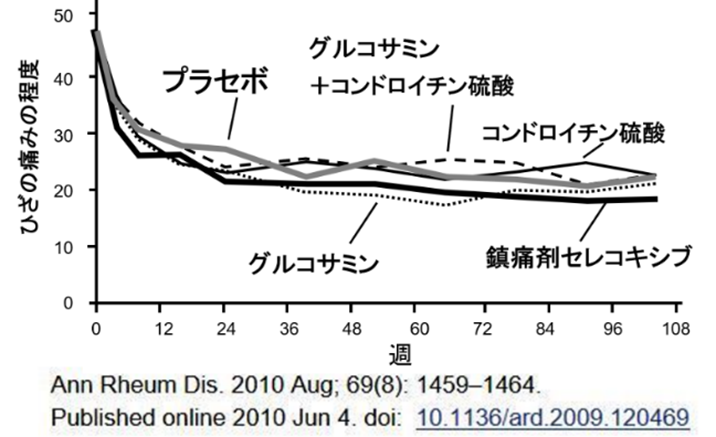
RCTは、プラセボ効果に比べて薬理効果が相対的に大きい症状の時にだけ使用できる試験法であり、両者の大きさにそれほど大きな差がない医薬品や健康食品には使用できないことは、薬理学の世界では常識的な事実である。これについて、厚労省課長通知『「臨床試験における対照群の選択とそれに関連する諸問題」について』(厚生労働省医薬局審査管理課長医薬審発第136号 平成13年2月27日)では次のように述べている。
『薬剤効果は、プラセボ対照試験の結果から明らかなこともある。しかし、有効と考えられている薬剤がプラセボ対照に優ることを示すことができない疾患は数多く存在する。その例として、うつ病、不安神経症、痴呆、狭心症、症候性うっ血性心不全、季節性アレルギー、症候性逆流性食道疾患のように、プラセボ群で大きな改善が認められたり、治療効果が小さかったり大きくばらつくものが挙げられる。この場合、標準治療が有効であることは疑いない。なぜなら、標準治療に用いられる各薬剤は、その効果を支持する数多くの試験があるからである。』そして、そのような場合にはRCT以外の適切な試験法を採用することを求めている。
このように、医薬品の試験では、RCTを推奨しながらも、それを義務化はしない、柔軟な取り扱いをしている。これに対して、健康食品の試験では、科学的な事実を無視して、RCTを義務化している。この事実は、健康食品に対して国が要求する科学的評価手法が、中立的な真実の探求ツールとして機能しているわけではなく、むしろ、「健康食品は効かない」という政策的結論を補強するように設計されたものであることを示している。健康な被験者を対象とし、軽症者に不向きなRCTを義務付けることで、制度は自らの「不要論」「無効論」を正当化するための「科学的エビデンス」を体系的に生産しているのだ。これは、科学が政策を検証するのではなく、政策が科学のあり方を規定するという、本末転倒な状況である。真の有効性を評価するためには、この方法論的誤謬から脱却し、試験法そのものの抜本的な見直しが不可欠である。
不適切な論文とその原因
不適切な試験法を義務化したことの直接の影響は、不適切な論文の続出という形で現れている。多額の費用と時間をかけてRCTを実施しても、試験品がプラセボより有効であることを、統計的有意差により証明しなければ、表示の許可は得られない。そこで出てくるのが、統計法の不適切な使用により、「無理に」有意差を出す手法である。そして、そのような不適切な論文を、十分な査読を行わずに、高額の掲載料を徴収して掲載する科学誌の存在である。そのような不適切な論文に対する厳しい批判があり、消費者庁は機能性表示食品の届出論文の中から、いくつかを摘発した。しかし、この問題の根源を作ったのは、RCTを義務化した消費者庁自身にあることについては、何のコメントもない。
紅麹サプリ事件をきっかけにして、届出だけで表示ができる機能性表示食品を廃止して、国が許可するトクホに一本化すべきという議論がある。しかし、トクホの有効性試験も、健常者を被験者として、RCTを実施するというものである。ということは、トクホの根拠論文にも、全く同じ深刻な問題が存在することは間違いない。機能性表示食品の根拠論文は、消費者庁ボームページに全て公開されているので、これを批判することは簡単である。他方、トクホの審査資料は一切公開されないので、批判のしようがない。もし公開されれば、このことが明らかになるだろう。
5 安全性の隙間:規制緩和の遺産
日本の健康食品を巡る問題の中で、消費者の生命と財産に直接的な脅威を与えているのは、安全性に関する規制の欠陥である。特に、単なる食品である「いわゆる健康食品」は、健康被害と経済被害の最大の温床となっている。この問題の根源は、成分を濃縮した錠剤・カプセル形状(サプリメント形状)の製品が事実上野放しになっている点にあり、その背景には、かつて存在した有効な規制が、非関税障壁の圧力の下で撤廃されたという歴史的経緯が存在する。
危害の源泉:サプリ形状の「いわゆる健康食品」
健康被害事例の多くは、「いわゆる健康食品」によって引き起こされている。これらの製品がもたらすリスクの核心は、その剤形にある。錠剤やカプセルといったサプリ形状は、以下の二つの理由から、通常の食品とは比較にならないほど高いリスクを内包している。
成分の濃縮:サプリ形状食品は、特定の機能性成分を天然の食品から抽出し、高度に濃縮したものが多い。その結果、通常の食事では到底摂取し得ない多量の成分を体内に取り込むことができてしまう。
過剰摂取の容易さ:サプリ形状食品は、味や満腹感を伴わずに摂取できるため、消費者は抵抗なく、長期間にわたって高用量を継続的に摂取しがちである。
この「濃縮」と「過剰摂取」の組み合わせが、予期せぬ健康被害を引き起こす主要なメカニズムである。通常の食品であれば、含有量の限界や満腹感といった安全装置が働くが、サプリ形状食品はこれらを迂回してしまう。
決定的な規制緩和:46通知の形骸化
かつて日本には、こうしたサプリ形状の製品がもたらすリスクを管理するための規制が存在した。それは、1971年(昭和46年)に旧厚生省薬務局長通知として発出された「無承認無許可医薬品の指導取締りについて」(薬発第476号)、通称「46通知」である。
この通知は、「医薬品」と判断するための4つの基準(成分、形状、効能効果、用法用量)を提示した。特に重要だったのが「形状」に関する基準である。46通知は、アンプル形状など「専ら医薬品的形状」のものは、その成分にかかわらず原則として医薬品とみなすと規定していた。この規定により、サプリ形状の製品は、たとえ中身が食品由来成分であっても、無承認無許可医薬品とみなされ、その製造・販売が厳しく制限されていた。これは、サプリ形状が持つリスクを防ぐための、極めて有効な対策として機能していた。
しかし、この規制は2001年に撤廃された。その背景には、米国政府から日本政府に対して毎年提出されていた「日米規制改革要望書」などを通じた、市場開放への強い外圧があった。特に、米国でDSHEA法の下で巨大産業となっていたサプリメント市場の日本への参入障壁として、形状規制が問題視された。ビタミン類が、栄養機能食品として、医薬品から食品へと区分変更されたのも、この規制緩和の一環であった。
規制なき製品の氾濫
形状規制が撤廃された結果、サプリ形状の「いわゆる健康食品」が大量に流通することになった。これが、現在の市場における安全性問題の主要な原因である。それは、国民の健康保護という国内政策の優先順位が、貿易の自由化という対外政策の目標の下に置かれた、予見可能な帰結なのである。その解決は、かつての46通知の「形状そのものがリスクを内包する」という思想を復活させ、サプリ形状の製品群を、一般食品とは異なる特別な規制の枠組みの下に置くことから始めなければならない。しかし、規制緩和によって生まれたサプリ形状食品の巨大産業の存在が、その本質的な解決を困難にしている。
6 改革議論の不毛:現行改革案の問題点
日本の健康食品制度が抱える問題点が露呈するにつれ、新たな法整備の必要性については、社会的なコンセンサスが形成されつつある。特に、日本弁護士連合会(日弁連)からは、法規制を求める声が上がっている。しかし、現在主流となっている改革案の多くは、制度が抱える根本的な欠陥を直視せず、対症療法的な規制強化に終始しており、真の解決には程遠い。特に日弁連の提案は、旧来の「不要論」の思想に囚われており、消費者のニーズや市場の現実を無視した、時代錯誤的な解決策と言わざるを得ない。
日弁連の提案とその批判
日弁連が提唱する改革案の核心は、届出制である機能性表示食品制度を廃止し、国の審査を必要とするトクホ制度に一本化すべき、という点にある。この提案の根底にあるのは、「健康食品不要論」と「食薬区分」という旧来のパラダイムであり、国の厳格な管理下に置けないような多様な健康食品は市場に存在すべきではない、というものである。この提案には、以下の欠陥がある。
消費者のニーズの無視:そもそも機能性表示食品制度は、時間とコストがかかりすぎるトクホ制度の限界を乗り越え、より多様でアクセスしやすい選択肢を消費者に提供するために創設された。加えて、消費者を機能性表示食品に誘導することにより、「いわゆる健康食品」を少しでも減らすこと、さらに、増え続ける医療費をセルフメディケーションにより、少しでも削減する目的もあった。機能性表示食品を廃止し、高コストなトクホに回帰することは、「いわゆる健康食品」を増やすことで、リスクを増やし、市場の多様性を損ない、消費者の選択肢を狭める結果しかもたらさない。
根本問題の看過:日弁連の提案は、制度の運用形態(届出制か許可制か)のみを問題にしており、「有効性評価手法そのものの科学的欠陥」という、より本質的な問題に全く触れていない。仮に全ての製品がトクホになったとしても、現行の不適切な評価ガイドラインが維持される限り、「健康食品は効かない」という誤った結論が再生産され続けるだけである。
時代への逆行:日弁連の解決策は、市場を縮小させ、選択肢を制限するという、後ろ向きなものである。それは、健康課題に主体的に対処したいという国民の欲求に応えるものではなく、合理的な規制によって市場を健全に育成するという視点を欠いている。
紅麹サプリ問題のような失敗が発生すると、より柔軟な制度(機能性表示食品)を廃止し、より厳格な旧制度(トクホ)に回帰しようという動きが強まる。しかし、これは制度の実装の問題を、制度そのものを廃止することで解決しようとする短絡的な思考である。真の改革とは、トクホか機能性表示食品かという二者択一を迫ることではない。それは、両制度に共通する欠陥を正し、健康食品に関する、全く新しい統一的枠組みを構築することであるべきだ。
おわりに 「健康食品法(仮称)」によるパラダイムシフト
求められているのは、規制のパラダイムそのものを転換する、包括的な「健康食品法(仮称)」の創設である。
新たな法律は、以下の5つの基本原則に基づき、健康食品規制を現実に適合させるものでなければならない。
統一的な法的定義と社会的使命の確立:「健康食品」を食品と医薬品の中間に位置する独立したカテゴリーとして法的に明確に定義する。その上で、その社会的使命を「国民の健康維持・増進と、主体的な健康管理(セルフメディケーション)を支援すること」と規定し、規制の拠り所となる明確な理念を確立する。
リスクと科学的根拠に基づく分類体系への再編:消費者を混乱させる現行の4層構造を撤廃する。代わりに、科学的根拠のレベルと製品形状がもたらすリスクに基づいた、簡素で理解しやすい2段階程度の分類体系(例:成分の研究レビューに基づく「一般健康表示」と、最終製品での臨床試験に基づく「特定健康表示」)に再編する。
目的に適合した有効性評価手法:「健康食品は効かない」という結論を生み出す現行の評価ガイドラインを見直す。疾病予防効果の主張に対しては、バイオマーカーの変動や基礎研究からの科学的類推を証拠として許容する。軽症状態の改善効果の評価においては、RCTの義務化を改めて、無処置対照試験など、より適切な臨床試験の試験を採用する。
安全管理体制の再構築:保健機能食品については十分な安全管理体制が実施され、これをさらに強化する動きがある・そのような動きから取り残されている「いわゆる健康食品」の安全性の向上のために、かつての「46通知」の理念を復活させ、サプリ形状の食品に対して特別な規制を課す。具体的には、サプリ形状の食品はすべて保健機能食品とみなして、同等の規制を実施することである。
実用性がある消費者教育:科学的根拠、安全性情報、製造者情報などを網羅した、透明性の高いデータベースを公開と、具体的なセルフメディケーションの方法についての消費者教育の実施により、消費者が自らの判断で情報を比較検討し、自身の健康維持のための賢明な選択を行うことを支援する体制へと転換する。
(了)
<プロフィール>
唐木英明東京大学名誉教授(食の信頼向上をめざす会代表)
1941年生。農学博士、獣医師。1964年東京大学農学部獣医学科卒。テキサス大学ダラス医学研究所研究員を経て、87年に東京大学教授、同大学アイソトープ総合センター長を併任、2003年に名誉教授。日本薬理学会理事、日本学術会議副会長、(公財)食の安全・安心財団理事長、倉敷芸術科学大学学長などを歴任。専門は薬理学、毒性学、食品安全、リスクコミュニケーション。これまでに瑞宝章(中綬章)、日本農学賞、読売農学賞、消費者庁消費者支援功労者表彰、食料産業特別貢献大賞など数々の賞を受賞。
「食品安全ハンドブック」丸善2009、「検証BSE問題の真実」さきたま出版会2018、「鉄鋼と電子の塔(共著)」森北出版2020、「健康食品入門」日本食糧新聞社2023、「フェイクを見抜く(共著)」ウェッジ2024など著書多数。























