スタートした輸入原材料GMP認証 要求事項は?審査の流れは?料金は?
7月25日、健康食品GMP第三者認証機関の(一社)日本健康食品規格協会(池田秀子理事長。以下、JIHFS)が、海外から輸入される原材料に対するGMP(適正製造規範)認証事業を開始した。健康食品による健康被害の防止に役立てたい考えだ。ここにきて新しく登場した健康食品GMP認証のポイントを以下にまとめる。
国内で分析試験実施が要件 品質「再確認」した上で供給
日本の健康食品に関する第三者GMP認証は従来、国内における最終製品や原材料の製造施設が対象。海外から日本へ輸入される原材料に対する認証はこれまで行われていなかった。しかしその一方で、公的な統計はないものの、日本で販売される健康食品に用いられる原材料は、国内製造よりも、欧米やアジアなど海外で製造されるものの方が圧倒的に多いとみられている。
そうした中で、JIHFSは、輸入原材料GMP認証の主眼を、「国内におけるロットごとの分析試験の実施」に置いた。つまり、海外から輸入される原材料を製造ロット毎に、国内に複数ある公的な分析試験機関(登録試験機関)においてパターン分析などを実施する。それによって、規格から外れていたり、過去のロットにないピークが現れたりしていないかを確かめる品質管理の実行を、とりわけ重要な認証要件(要求事項)に据えた。製造元が出荷前検査で保証した品質を国内で再確認するかたちになり、品質管理レベルの強化にもつながる。
「ロット毎の分析はハードルが高い」。一部の輸入事業者はそう指摘する。それ対して「実際にそうだろうと思う」と返すのはJIHFSの池田理事長。ロット毎に分析を行うことは、輸入原材料事業者にとって決して容易でないことを認める。
ただ、小林製薬「紅麹サプリ」問題の背景には、本来含まれないはずの異物(青カビ由来のプベルル酸)を含む原材料が製造され、それに誰も気づかぬまま出荷されてしまったことがある。それが最終製品(サプリメント)になり、全国の消費者が摂取するに至った。原材料の製造元であった小林製薬が、異物が含まれることに気づき、最終製品製造工場への出荷を止めていれば、今回の問題は防げた可能性が高い。
以上をまとめると、JIHFSが新たに始める輸入原材料GMP認証の要諦とは、「起こりえない」と言い切ることはできない、海外の製造元が過失で粗悪・不良な原材料を作り、出荷し、輸入事業者が国内に受け入れ、供給し、消費者が摂取してしまうことを、水際(最終製品製造工場へ出荷される前)で食い止めることにある。そこで食い止めることができれば、ダメージを最小限に抑えられる。そうするためには、原材料を国内に受け入れた後、製造ロットごとの分析を実施し、製品標準書や、その原材料の標準分析パターンに適合しているかを確認する必要がある。
その上で実地監査、そして外部有識者交えて審査
JIHFSは、健康食品に用いられる原材料は海外製が圧倒的に多い実態を踏まえ、輸入原材料GMPの規範書を5年前に作成していた。
しかし当時は認証をすぐに開始すべき状況でもなく、そのまま寝かせておいたが、昨年、実施に向けて再検討を開始。その発表が視野に入ってきた中で、機能性表示食品をめぐる健康被害問題が起きる。問題を受け、JIHFS理事会は、原材料の安全性と品質の確保に向けた取り組みを推進する必要があると判断。輸入原材料GMP認証の事業化と、速やかに認証に着手することを決めた。
輸入原材料GMP認証の基盤となる規範書。そこには、認証を求める輸入原材料事業者への要求事項として、ロット毎の国内での分析試験実施やサンプル保管などの品質管理事項の他に、総括管理者などの品質管理のための社内組織体制の構築、輸入する原材料に関する製品標準書の作成、輸出国(海外製造元)での製造管理・品質管理方法と関連文書の確認、輸入原材料の受け入れ・保管・表示・出荷可否なその管理、文書及び記録の管理──など14事項が盛り込まれている。最終製品や原材料の国内製造工場GMP規範と比較するとかなり少ない。
認証までの流れは、下の図のとおり。
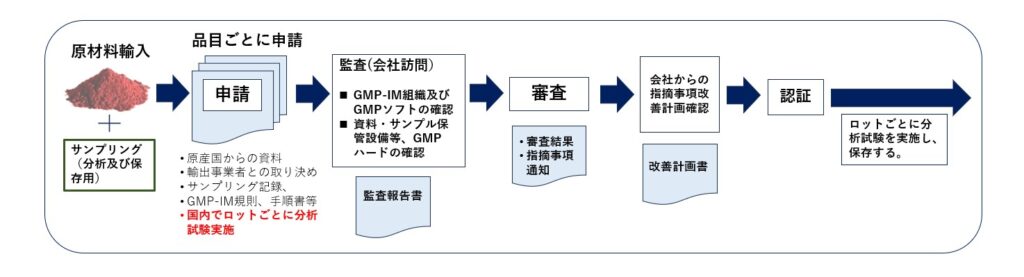
審査については、JIHFSが外部から招へいする有識者3人を含む審査会で行う。審査委員長には外部から、袴塚高志 ・日本薬科大学薬学部薬学科社会薬学分野教授が就く。この審査会は、JIHFSが輸入原材料GMP認証とは別に新たに立ち上げる、原材料の安全性自主点検に関する認証事業(6月24日付既報)にも関わることになる。
そして料金。JIHFS会員企業と非会員企業で分ける。会員企業の場合、1品目(原材料)あたり8万円。輸入原材料事業者の組織体制、原材料保管倉庫、原材料規格書等の関連書類などの実地監査を行う初回及び3年毎の更新時に求める費用を含めても1品目あたり25万円に抑える。非会員企業は、40万円前後。安全性や品質上のトラブルを回避するためのコストと考えれば、高額とは言えないのではないか。池田理事長は取材に、「私たち(JIHFS)の利益はわずかです」と語った。
新・機能性表示食品制度と輸入原材料GMP認証の関係
小林製薬「紅麹サプリ」問題を受けて実施されることになった機能性表示食品制度の見直し。サプリメント(天然抽出物等を原材料とする錠剤、カプセル剤等食品)の製造工程管理、品質管理については、法令(告示)で定めるGMPを遵守する義務がかかることになる。対象は最終製品であり、原材料に関しては直接の対象にはならない。ただ、同告示案の第4条「届出者の責務」に、以下の定めが盛り込まれていることは押さえておきたい。
「届出者は、天然抽出物等を原材料とする錠剤、カプセル剤等食品の製造等に使用する原材料(機能性関与成分を含む原材料に限る)について、製造者等が作成する製品標準書に記載した規格に適合したものが供給されることを確保しなければならない」
その原材料が規格に適合していることや不純物が含まれないことを届出者としてどのように証明していくか。それが輸入原材料である場合、輸入事業者の協力が必要不可欠になる。コストはかかるが、国内への受け入れ後、ロット毎の分析試験を必須とするJIHFSの輸入原材料GMP認証は、規格への適合を証明する有力な手段になると考えられる。
【石川太郎】
(文中の図:JIHFS輸入原材料GMP認証の流れ。3年ごとに更新が必要。JIHFS提供)






















