岐路に立つ機能性表示食品 6・30措置命令の衝撃、エビデンス見直し迫る消費者庁
暗示で効果を伝えるしかない、いわゆる健康食品の世界に戻るつもりはない。「さくら事件」とも呼ばれる機能性表示食品をめぐる措置命令事案に対し、健康食品事業者はそんな気概も見せる。アクセルを踏み込み過ぎた広告が、届出表示の科学的根拠にダメを出す、初の景品表示法違反(優良誤認)事案につながった。重く受け止めたのは業界だけではない。食品ヘルスクレーム制度を所管する消費者庁も同様だ。大ナタを振るって科学的根拠の見直しを迫る。
それは広告から始まった
6月30日午後、東京・霞が関の中央合同庁舎4号館。消費者庁が入居する同庁舎の4階、共用第2特別会議室にメディアが集まる。前日の夕刻、景品表示法に関する個別案件、つまり「措置命令」について記者レク(記者説明)を行う旨の連絡が同庁広報室から寄せられていた。その時点で詳細は不明。問い合わせても「(発表まで)答えられない」(表示対策課)。だが、推測は出来た。保健機能食品に関わる措置命令の可能性が高い──。説明者の中に、景表法は管轄外である食品表示企画課保健表示室長の名があった。
記者席の机上に置かれた報道発表資料。タイトルは「さくらフォレスト株式会社に対する景品表示法に基づく措置命令について」。対象商品は「機能性表示食品」と記されている。その後の取材で、前年6月頃から調査が始まっていたとの情報を得る。広告表示が端緒になった。
午後3時、記者レクが定刻に始まる。記者の向かいに座る説明者は、表示対策課の口ノ町達朗上席景品・表示調査官、田中誠ヘルスケア表示指導室長(当時)、そして食品表示企画課の蟹江誠保健表示室長(同)の3人。健康食品業界を上に下に大きく揺さぶることになる措置命令について説明の口火を切ったのは、上席調査官だった。

この記者レクの全容は、㈱ウェルネスニュースグループが運用する公式YouTubeチャンネルにアップロードされた動画で確認できる。報道発表資料に目を通すだけでは何が問題になったのかは分からない。説明が進むにつれて、前回2017年に起きた機能性表示食品をめぐる措置命令とは性質が大きく異なることが見えてくる。
『きなり匠』と『きなり極』。措置命令の当日、記者レクが始まるまでに撤回届が提出されることになる両機能性表示食品には、機能性関与成分としてDHA・EPAが配合されていた。ヘルスクレーム(届出表示)は中性脂肪の低下。一方、『─匠』はほかに、モノグルコシルヘスペリジン、オリーブ由来ヒドロキシチロソールも配合されており、届出表示はそれぞれ血圧の低下、LDLコレステロールの酸化抑制だった。
科学的根拠に踏み込みダメ出し
違反事実の概要説明を始める上席調査官。まず指摘したのは、「血圧をグーンと下げる」の逸脱表示。届出の範囲を越え、医薬品の領域に踏み込まんとする危険な広告表示を景表法違反(優良誤認)と認定した。なるほど、そうであれば前回の措置命令と性質はさほど変わらない。前も届出表示からの広告のはみ出しが問題となった。
だが、違反認定された表示はそれだけにはとどまらなかった。「届出表示の裏付けとなる科学的根拠が合理性を欠いている表示」。違反認定された表示媒体が容器包装(商品パッケージ)にまで及んでいる理由がこれだ。
この措置命令は、届出表示から逸脱した広告表示だけではなく、届出表示そのものを違反認定したものである。要は、届出表示の裏付けとなる科学的根拠に踏み込み、ダメを出した──そのことを記者がはっきり認識できたのは説明の中途。この日をもって離任し、現在は同庁の消費者教育推進課食品ロス削減推進室専従の田中誠氏が説明を続ける。
DHA・EPAなど当該3機能関与成分について届け出された科学的根拠はいずれも研究レビュー(SR)。景表法の不実証広告規制に基づき提出された根拠を示す資料には各SRが含まれていた。
各SRは届出実績が数件にとどまるルーキーではない。中性脂肪を下げる働きを訴求する特定保健用食品の関与成分として許可されているDHA・EPAを筆頭に、相当数の届出を積み上げているベテランだ。しかし表示対策課は、届出表示の裏付けとなる「合理的な根拠にならない」と断じる。SRを提供した各原材料事業者らの援護射撃も撥ねつける格好になった。
判断の理由を成分個別に説明する田中氏。詳しくは記者レクを収録した動画をご覧いただきたいが、違反事実の概要説明としては踏み込んだ内容だったと言える。だが、後に健康食品業界から湧き上がることになる、時に怒り交じりの「なぜ?」を納得させるものでは全くなかった。(続きは会員専用ページへ)
総合的観点から肯定的といえるか
あれから3カ月超が経過した。今振り返ると、田中氏が言わんとしていたのは、SRに求められるトータリティ・オブ・エビデンスの観点から届出表示は肯定されない、ではなかったか。
トータリティ・オブ・エビデンスとは、「肯定的・否定的内容及び研究デザインを問わず検討し、総合的観点から肯定的といえるかを判断」すること。機能性表示食品の届出ガイドラインではそう説明している。また、その観点から表示しようとする機能性について肯定的と判断できるものに限り「科学的根拠になり得る」とする。
いずれにせよ、判断の理由について総合的な説明を求める事業者の声は今も消えていない。それが分からないままだと、トータリティ・オブ・エビデンスの観点に死角が生じる恐れがある。ある事業者はこう指摘する。「理由をしっかり説明してくれないと、同じ問題がまた繰り返される」
消費者庁の判断は正しかったか
「血圧をグーンと下げる」の広告はアクセルを踏み込み過ぎ。その指摘には多くの業界関係者が首肯するだろう。一方で、SRの中身にまで踏み込み、科学的根拠としての不備を洗い出した上で、届出表示は合理性に欠ける不当表示だと断じ、行政処分である措置命令を行うという、機能性表示食品をめぐり消費者庁が初めて見せた挙動を健康食品業界はどう受け止めたのか。
それを知るためにウェルネスニュースグループは措置命令後の7月、健康食品関連事業者を対象にしたウェブアンケート調査を行った。後述するが、この措置命令が機能性表示食品全体に影響を及ぼす「事件」であることがはっきりした後、「6・30措置命令」の受け止めなどを尋ねる約20問を事業者らに投げかけた。
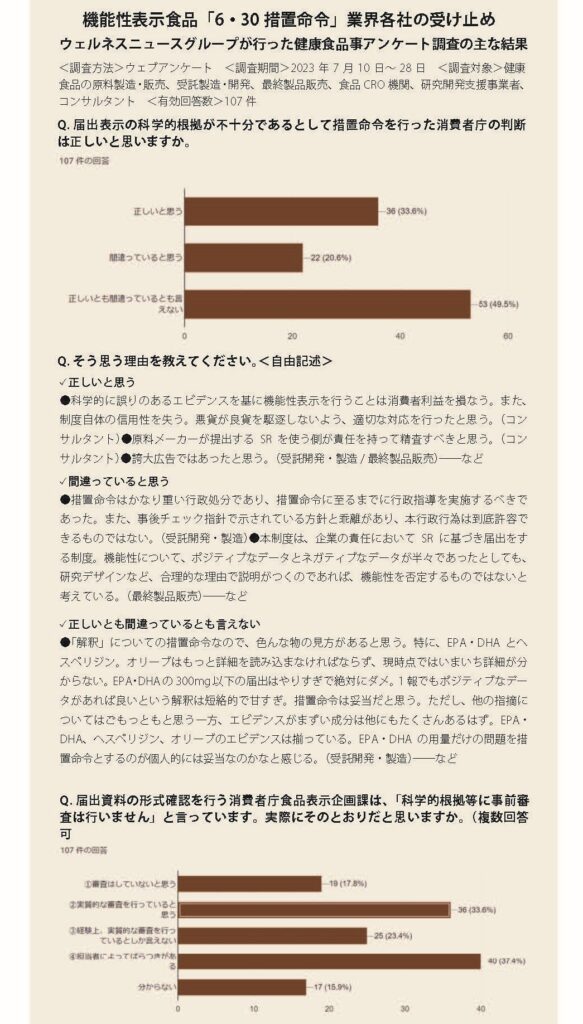
有効回答は107件。まず、科学的根拠に踏み込んだ措置命令を行った消費者庁の判断の是非を尋ねる設問では、約50%が「正しいとも間違っているとも言えない」と回答。次いで、「正しいと思う」が約34%、「間違っていると思う」が約21%で続いた。「正しい」が意外に多い。
また、そのように思う理由について自由記述で尋ねた。
「正しいとも間違っているとも言えない」と回答した事業者からは、「広告内容は不適切で妥当。科学的根拠については判断の詳細が不明で正しいかどうか分からない」、「届出内容を審査している訳ではないことは把握しているが、一気に措置命令という処分は重すぎる」、「科学的観点では理解できるが、いったん受理した届出に対して今回の措置は厳しい」、「SRを見たが、論文の母数が多く、かなり専門的に見ないと妥当性が判断できない。このままだと、多くのエビデンスのある素材が敬遠され、エビデンスの少ない素材が人気になるという本末転倒が発生したり、中小企業では手を出せない制度となってしまう可能性がある」、「エビデンスがまずい成分は他にも沢山あるはず』──などといった意見が寄せられた。
一方、「正しい」と回答した事業者の見解はこうだ。
「科学的に誤りのあるエビデンスを基に機能性表示を行うことは消費者利益を損なう。また、制度自体の信用性を失う」、「論文の内容を都合よく解釈してSRの形にし、届出している実態が明らかになった」、「科学的根拠を基に届出を行う制度であるから」、「制度上は届出制だが、違反が分かった時点で何らか措置を行うのは機能性表示食品の制度主旨に合うため」、「不十分であると判断された科学的根拠について、販売者が正当な説明を出来なかった」──。
企画課と対策課のWスタンダード
アンケート結果の特徴として、自由記述への回答が多く、熱を帯びた回答も見受けられたことがある。「間違っている」と回答した事業者からは以下の見解が寄せられた。長いが全文を引用する。
「機能性表示食品の届出を受理するに際して、消費者庁は科学的根拠の実体的審査は行わないという建付けになっている。これは、受理後に第三者から科学的根拠について疑義が訴えられた場合は消費者庁が双方の意見に基づいて吟味し、科学的根拠が不十分と結論付けられれば、機能性表示の要件を満たしていないということで取り消しの措置を取ればいい。この制度は、そもそもこのような結末も想定した制度ではないのか。
これにさらに不実証広告規制による措置命令を出すというのは、単一省による二重措置にならないか。食品表示法によって受理され販売されたものについて、その制度の範囲内で企業は行動しているにも関わらず(機能性表示を逸脱した広告を除く)、別の法律で行政措置を受けるのは納得できる話ではない。表示法と防止法との間に整合性が取れていないという事態ではないのか。届出された内容に基づいて行った表示が不当表示だと言うのなら、消費者庁が自分でそのような表示の食品の販売を認めて、不当表示事案を惹起したということではないか」
ダブルスタンダード。機能性表示食品をめぐり消費者庁はそう批判されることがままある。6・30措置命令後にもそうした声が上がった。届出資料を受け付け、届出番号を付与したのも、届出資料の中身(科学的根拠)を調査し、行政処分を行ったのも、同じ「消費者庁」だからだ。
無論、機能性表示食品制度は許認可制ではなく届出制。同庁も「科学的根拠等の事前審査は行っていない」などと再三にわたり説明している。だが、事業者の受け止めは異なる。アンケートでは、実際に事前審査は行われていないと捉えているかどうかを複数回答で尋ねた。
「審査はしていないと思う」の回答は約18%にとどまった。それに対して「実質的な審査を行っていると思う」は約34%とおよそ2倍。「経験上、実質的な審査を行っているとしか言えない」の回答も約23%に上り、同庁がいくら否定しようとも、審査が行われていると受け止めている事業者が一定数、存在することが分かる。
届出資料の提出から届出番号が付与されるまでに、何度も差し戻されることもあるのだから、そう捉えられても仕方あるまい。アンケートの自由記述では、「エビデンスの中身、エビデンスと届出表示の整合性、届出表示自体、非常に多岐かつ細部にわたり指摘がある」、「作用機序について、かなり突っ込んだ指摘を受けたことがある」、「科学的根拠の中身に対して、かなり詳細な不備指摘事項を受けた経験が何度もある」──などといった経験談が寄せられた。その上で届出後、科学的根拠の不備を指摘されて納得できる事業者がどれほど存在するだろうか。
判断基準は変わる、ならば周知徹底を
それだけではない。この設問で最も回答が多かったのは、「(届出資料を確認する)担当者によって(指摘に)ばらつきがある」(約37%)だ。
前に届け出たのと同じ内容なのに差し戻されたり、他社が届け出ているのと同じヘルスクレームなのに不備を指摘されたりといった、いわゆる「ゴールポストが動く」現象を経験している事業者は多い。そのような予見可能性の無さも、「審査されている感」を熟成させてきた原因といえる。
この点、消費者庁に理由を言わせれば、「科学などの進展に合わせて判断基準は刻々と変化する」といったところだろう。それはそうだとしても、であれば、判断基準を変更する際は業界への周知徹底に努めるべきだ。ある販売会社の担当はこう話す。「こちらは修正しなければならないし、あちら(消費者庁は)差し戻さなければならない。お互いに手間がかかるだけで何もメリットがない」
公正を期し、「審査はしていない」と回答した事業者の声も一部紹介しておく。
「ここ2~3年の申請においては、科学的根拠について不備指摘を受けていない」、「論文の内容で差し戻しになったことはない」、「届出表示の文言については審査していると思う。科学的根拠については届出資料(別紙様式Ⅴ)に記載された内容を基に審査に似た確認を行っていると思うが、採用論文の中身を含めた審査は行っていない」、「審査などするマンパワーはないと思う」──などといった声が寄せられたほか、「今回(6・30措置命令)のようなことがあった」から審査はしていない、という意見もあった。
措置命令後の対応、目的は「浄化」?
機能性表示食品の科学的根拠が問題になったのは、何も今回が初めてではない。現在までに700件を超える撤回された届出の中には、それを理由とするものがある。届出後、科学的根拠に疑義が生じ、消費者庁から届出の撤回を勧奨される。そのようにして取り下げられた届出が少なからずある。その中で、6・30措置命令の最大の謎は、なぜ措置命令にまで至ってしまったのかだ。いくつかの理由が憶測されているが、ウラがほとんど取れていないのでここでは触れない。
ただ、措置命令を行い、発表するのとほぼ同時(7月3日)に消費者庁が始めた対応を見ると、機能性表示食品の科学的根拠を浄化させようとしているのではないかとさえ思えてくる。この対応が、6・30措置命令を、機能性表示食品全体を巻き込む事件に発展させた。
同庁が取った対応は、まず、措置命令対象商品の『きなり匠』などと同一の機能性関与成分および科学的根拠を届け出ていた機能性表示食品88件について、科学的根拠の不備を指摘し、合理的な回答を求めた。その上で、回答状況を、商品名や届出者などとともに同庁のホームページ上でさらした。さすがにこれには「やり過ぎだ」と非難の声が上がった。
この対応は、実質的には届出の撤回勧奨だろう。表示対策課の判断に従えば、これら88件の届出表示は景表法違反状態であり、科学的根拠に基づき表示する機能性表示食品の要件も満たしていないことになる。もっとも、疑義を覆す合理的な科学的根拠を提示することができればそうとも言えなくなるが、今度は措置命令の正当性が問われることになる。そのため同庁の本音は、「早く撤回を申し出てもらいたい」であったはずだ。
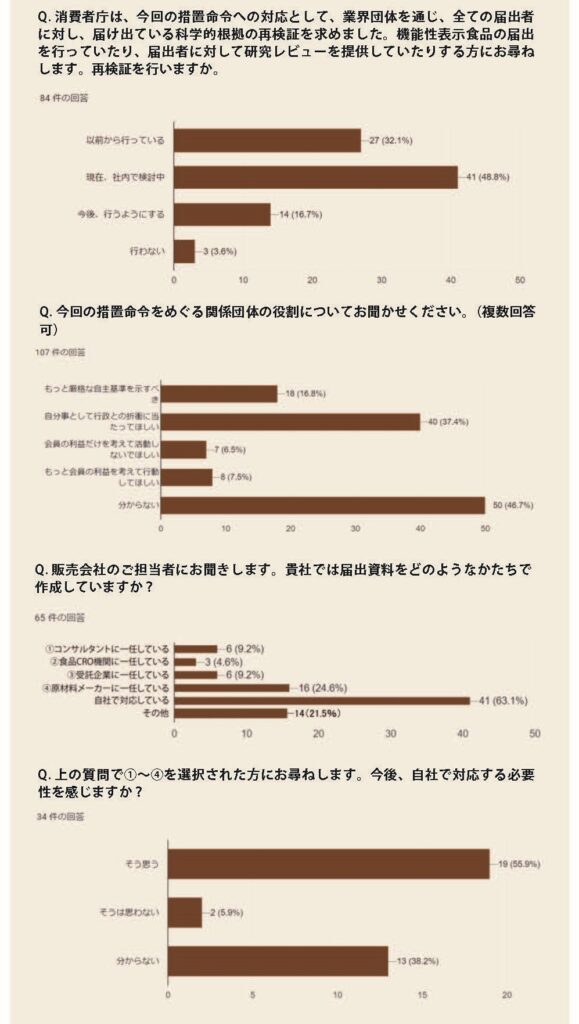
実際、そのとおりになった。回答状況は当初(7月27日時点)、88件のうち73件が科学的根拠等があると主張。撤回申出は15件にとどまり、多くの事業者がファイティングポーズをとった。それが一転、翌月16日までに撤回申出が80件にまで急増。複雑な思いを抱えながらも業界が消費者庁に協力する格好となった。
同庁はまた、科学的根拠を改めて再検証(見直し)するよう、業界団体を通じて全ての届出者に求めた。「機能性表示食品は、特定保健用食品と異なり、表示される機能について国が個別に許可しているものではなく、表示の裏付けとなる科学的根拠が合理性を欠くと認められる場合には、その表示は景表法等に基づく虚偽誇大表示や食品表示法に基づく食品表示基準違反に当たるおそれがある」と警告してもいる。
再検証から事業者が逃れられない仕組みも作った。9月29日付の届出ガイドライン一部改正(第10次)に盛り込んだ、SRの作成について「PRISMA声明(2020年)」に準拠することを原則とする改正がそれだ。これまでは同声明の旧版にあたる「2009」への準拠を求めていた。
これにより、期限こそ設けないものの、SRが見直されていく道筋を整えた。新規届出について2020に準拠したSRの届出が必須とする2025年4月1日以降、2009から2020への更新状況を一般消費者に情報提供していく考えも示している。
ガイドライン改正ではほかにも、届け出た内容に対する責任の所在を明確にする仕組みを取り入れた。「届出資料作成に当たってのチェックリスト」(別紙様式2添付ファイル用)に届出者の代表者による確認欄を新設。届け出た科学的根拠に対する責任を負うのはSRの実施者や提供者などではなく、届出者自身であることを明確にさせる狙い。「原材料メーカーが問題ないと言うから問題ないと思った」などとして科学的根拠の責任を転嫁しようとする道を塞いだといえる。
事業者は言う「この制度を残さなければ」
6・30措置命令を受けて、事業者が届出に萎縮する可能性も指摘された。届出制である機能性表示食品につきまとうリスクを実感した事業者が少なかったはずだ。
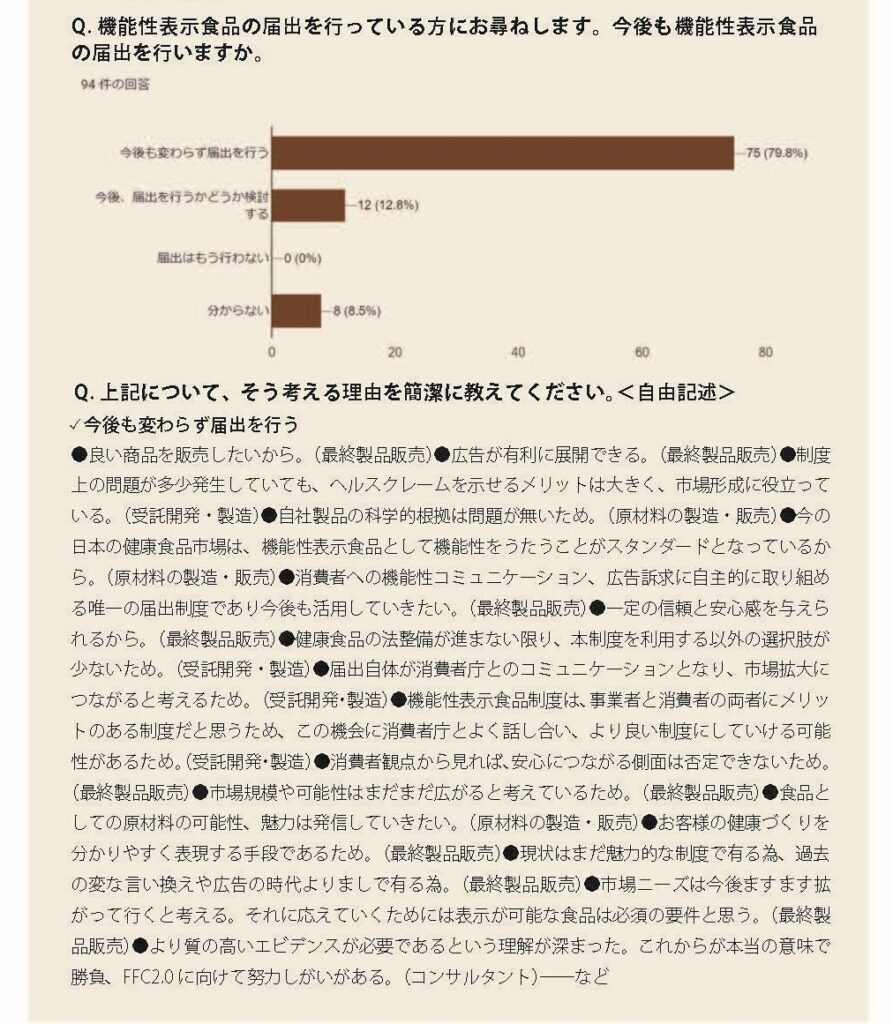
そこで、前述の事業者アンケートには、今後の機能性表示食品の届出に対する意向を尋ねる設問も盛り込んだ。結果は、「今後も変わらず届出を行う」が80%。「届出はもう行わない」を選んだ事業者は、意外にも皆無だった。
今後も届出を行うと回答した事業者の声を紹介して本稿を終える。
「健康食品の法整備が進まない限り、本制度を利用する以外の選択肢が少ない」、「ヘルスクレームを示せるメリットは大きく、市場形成に役立っている」、「(機能性を)表示できないデメリットが大きい」、「商品戦略上、必要だから」、「この制度を残さなければ、エビデンスに沿わないもっと粗悪な商品が出回ってしまう」、「事業者と消費者の両者にメリットのある制度だと思う。この機会に消費者庁とよく話し合い、より良い制度にしていける可能性がある」、「科学的根拠のある食品成分の機能を、いかに正確でかつ消費者に分かりやすく表示するかという大きなテーマがある。これらに頭を使い、チャレンジしていくことが、日本の経済活性と国民の健康に寄与していくのだという、夢を持って取り組みたい」──。
【石川太郎】
(文中の写真:記者レクの様子。左から田中氏、口ノ町氏、蟹江氏。6月30日、中央合同庁舎4号館)
『ウェルネスマンスリーレポート』2023年10月号(第64号)より転載






















